第一章 染色质的结构和功能
1.1.2 细胞核的功能
(1)核蛋白入核:细胞核定位信号(NLS)
核蛋白入核分两步:核孔处结合NLS;迁移进入核质
促进结合的NLS受体,可以往返于NPC(核孔复合体)。
(2)蛋白质出核:核输出信号(NES)
在细胞质中合成的某些蛋白质,被输入细胞核,然后再输出细胞核,这种蛋白质大多为转录因子,通过它们的定位来控制其活性。
蛋白质的入核和出核的调控:
1) 转运受体对运输物质的直接修饰(磷酸化修饰);
2) 运输物质在解除锚定前,可固定在某一区域而不与转运子一起移动;
3) NPC的转运能力被调控。
1.3.3 核小体相位(phased positioning)
功能:核小体在特定的DNA上的相位是决定基因在细胞内能否被活化和转录的关键。
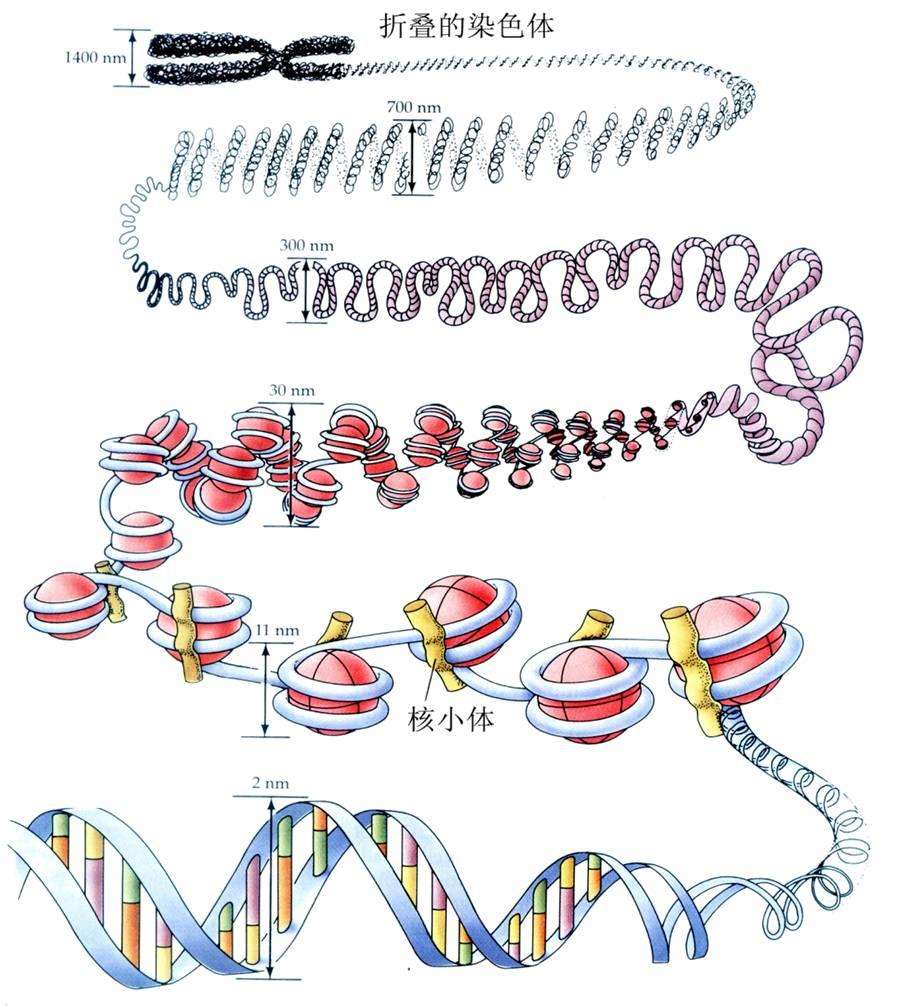
1.4.1 染色体的化学组成
1.组蛋白:组蛋白的N端尾巴游离于核小体之外,可进行多种类型的转录后修饰:乙酰化、甲基化、磷酸化、泛素化等。
第二章 核小体定位
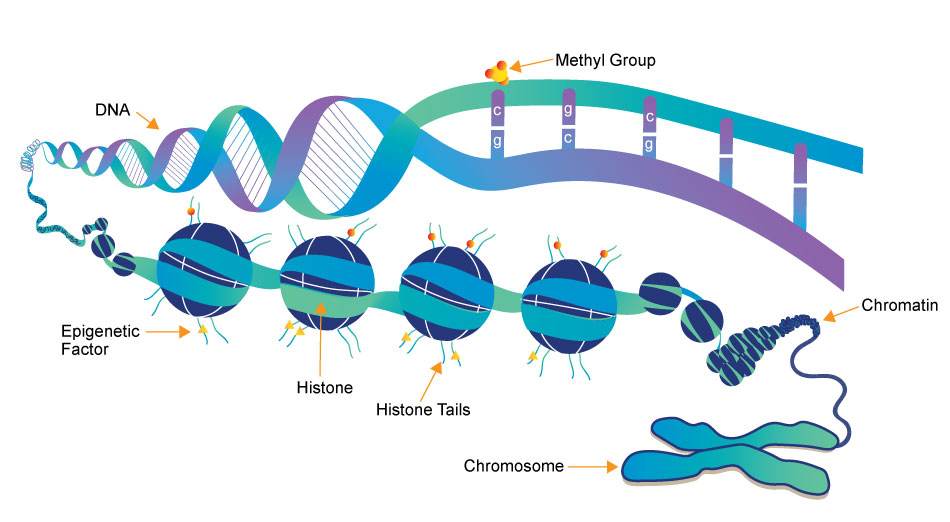
基因组上核小体定位、组蛋白修饰、染色质重塑等已成为表观遗传学的重要内容。
第三章 染色质重塑
-
一般意义上的遗传学指基于DNA序列改变导致基因表达水平的变化,如基因突变、基因杂合丢失和微卫星不稳定等;
-
表观遗传学则指非DNA序列改变所致基因表达水平的变化;这种改变是细胞内除了遗传信息以外的其他可遗传物质发生的改变;
-
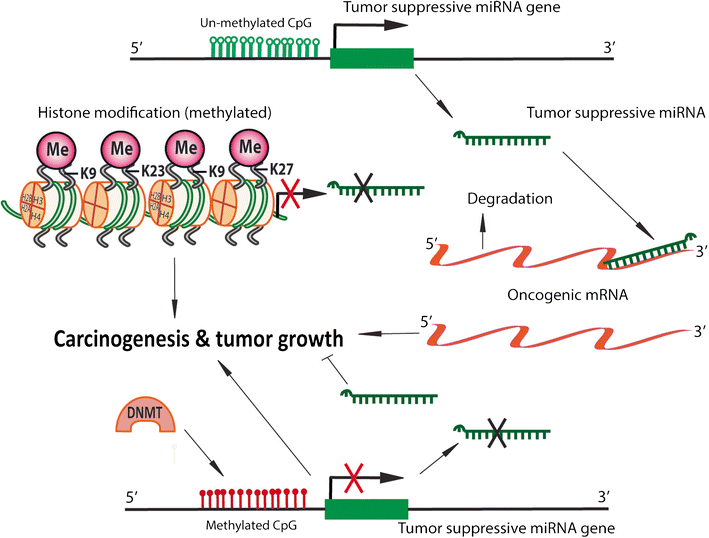
表观遗传学研究主要包括染色质重塑、组蛋白修饰、DNA甲基化、X染色体失活、非编码RNA调控等,任何一方面的异常都将影响染色质结构和基因表达,导致复杂综合征、多因素疾病以及癌症的发生。
3.1 染色质重塑概述–重塑子
重塑子(remodeler)利用水解ATP的能量通过滑动、重建、移除核小体等方式改变组蛋白与DNA的结合状态,使蛋白质因子易于接近目标DNA。
第四章 组蛋白修饰
4.1.1 组蛋白的分类和性质
在细胞里,DNA以染色质的形式存在,核小体是染色质的基本结构单位。核小体是由核心组蛋白八聚体(2个拷贝的H2A、H2B、H3、H4)及缠绕其外围长度为146bp碱基对的DNA组成,组蛋白H1与核小体间的DNA结合。
-
组蛋白是真核生物体细胞染色质中的碱性蛋白质,富含精氨酸和赖氨酸等碱性蛋白质;
-
组蛋白的基因非常保守;
-
H1属于另一类组蛋白,它不参加核小体的组建,在构成核小体时起连接作用,并赋予染色质以极性;
-
染色质中组蛋白以外的蛋白质成分称为非组蛋白。
4.1.2 组蛋白修饰的种类
目前已知某些酶和蛋白质复合体通过多种机制影响染色质的状态。
有两类物质参与了染色质构型重建:
- ATP依赖的染色质重塑复合物(4个家族),它们能利用ATP水解产生的能量使染色质构型改变或核小体滑动;
- 染色质改变因子,它们通过组蛋白共价修饰发挥生物学作用。
每个核心组蛋白都有两个结构域:组蛋白的球形折叠区和氨基末端结构域(N末端):
- 氨基末端结构域像一条“尾巴”,可以发挥“信号位点”的作用,这些位点常被各种酶作用,发生共价修饰:乙酰化、甲基化、磷酸化、ADP核糖基化、泛素化和羟基化等。
组蛋白甲基化
组蛋白甲基化不同于其他的组蛋白修饰,它可以发生在精氨酸和赖氨酸的侧链。
- 不同位点的甲基化对于基因的表达可以起到抑制或促进的作用;
- 在同一位点,甲基化数目的不同也可以对基因的表达产生不同的影响;
- 甲基化还可能作用于DNA的一定区域;
- 甲基化还能够影响可变剪接。