第五章 信号转导与基因调控
-
潜在转录因子参与了一些重要的信号转导途径,这些途径由关键蛋白介导并以此命名,如SMAD、STAT、NFKB、Hedgehog、Wnt、Notch和NFAT。所有这些途径的关键点是转录因子从细胞质转移到细胞核。
-
转录因子调控网络是生物网络的一种特殊形式,它显示了多个转录因子与不同组织中的靶基因、细胞背景和时间点的复杂联系。
-
真核基因表达的复杂性反映了它所调控响应的多样性。为了理解转录因子网络的拓扑结构和动力学,人们需要研究网络节点的定义和表达水平、网络节点相互作用如何随时间变化以及破坏关键节点对表型的影响。
-
在造血细胞中,仅过度表达一个关键转录因子就足以改变细胞命运。双向细胞命运选择中转录因子交叉拮抗作用对于细胞重编程是非常重要的。
-
在一个分化模型中,不同类型可以理解为转录因子网络的稳定吸引子。发育中间体如多能祖细胞显示了模型中的亚稳态。过表达异源转录因子的重编程将改变网络的稳态并过渡到另一个稳态。
-
二聚体NFKB复合物被lkB蛋白滞留在细胞质中,IKBK磷酸化lkB,导致其降解,从而使得NFKB移位到细胞核中并激活其靶基因。
-
最常见的NFKB激活途径也是最经典的途径,即由炎症刺激如TNFa和IL1B,或暴露于细菌产物如脂多糖(LPS)诱导引发的途径。在该途径中,IKBK的亚基NEMO是关键组分。
-
大多数NFKB阻遏机制涉及NFKB和配体活化的核受体之间的直接相互作用,使得NFKB蛋白被占用,从而抑制了炎症基因的激活。
-
巨噬细胞对LPS刺激的转录反应是由三类转录因子介导的:①NFKB;②CEBPD和ATF3;③SPI1、CEBPB、RUNX1和IRF8。
-
细胞压力的主要感受器是转录因子p53,它以四聚体形式结合到中间有10个核苷酸间隔的双拷贝共有序列上。
-
许多形式的细胞压力可诱发p53途径。细胞压力可由多种蛋白质检测到,这些蛋白质通过P53蛋白修饰及其负调控因子MDM2传递信息。
-
p53介导的靶基因激活及抑制,主要是通过p53序列特异性地直接结合到基因组调控区域来实现的。这样,p53可与基础转录因子、HAT、HDAC或其他转录因子如SP1、CEBPB和AP1发生相互作用,然后将其抑制。
-
50%以上的人类肿瘤是由于肿瘤抑制基因TP53突变或缺失引起的。
第六章 基因表达开关:核受体的例子
-
核受体是由小的亲脂性配体激活的转录因子。
-
后生动物中,核受体是最大的转录因子家族(人类有48类)。
-
核受体信号途径很直接:激活信号——配体穿过细胞膜后直接结合到转录因子——核受体上。
-
核受体超家族成员是通过高度保守的DBD区来界定的。
-
核受体超家族分为三类:①内分泌受体;②作为膳食化合物和异生物质(“领养孤儿受体”)的传感器;③真正的孤儿受体。
-
大多数核受体以同源二聚体或与RXR形成异源二聚体的形式与DNA相互作用。
-
核受体的识别元件(RE)由两个六核苷酸核心基序组成,该基序的共有序列是AGGTCA,它有三个相对的排列:①反向重复;②正向重复;③翻转重复。
-
核受体调控的主要生理过程是:代谢;细胞生长和分化;炎症。
-
许多例子表明,代谢物可以作为核受体的配体,而核受体反过来又调节控制代谢物浓度的酶和转运蛋白的表达。
-
核受体的LBD是一个三夹层的三明治式保守结构,其中在底部区域具有体积不等的配体结合口袋。
-
配体结合诱导LBD的构象变化,且主要影响螺旋12的位置。
-
没有配体的LBD与辅抑制蛋白相互作用,而在配体存在下它与辅激活蛋白作用。
-
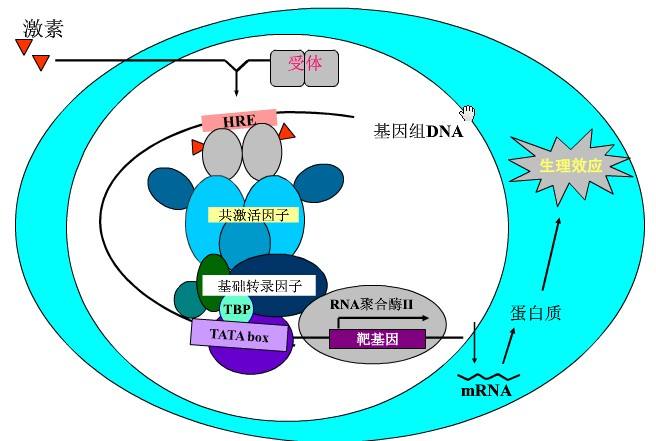
核受体的反式激活具有三个步骤:①配体不存在时,核受体通过辅阻遏蛋白和染色质修饰酶的作用导致染色质布局浓缩和基因的抑制;②配体存在时,核受体通过辅激活蛋白与另一类染色质修饰酶作用导致染色质局部解聚;③核受体改变了辅活化蛋白的类型,并通过中介复合物激活基础转录机器和RNA聚合酶Ⅱ。这样,最终导致核受体靶基因的转录。
-
核受体机器辅因子经历翻译后修饰,该修饰的信号转导途径起始于细胞膜的相应受体。
第七章 基因组作图
-
识别功能转录因子结合位点的比较基因组学称为进化足迹法。进化足迹法在具有5千万~7千万年进化分离的物种间(如人和啮齿动物)应用时效果最好。
-
进化足迹法主要有三步组成:①确定合适的可用于比对的纵向同源序列;②比对分析基因的调控区域;③展示或识别高度保守的区域。
-
调控元件的有效搜索应具备两个条件:①结合不同物种的比对分析;②含有开放的染色质和组蛋白修饰的实验数据。
-
ENCODE计划采用高通量方法如ChIP-seq来鉴定和分类人类基因组上的功能元件。
-
ENCODE计划的主要成果:①将人类基因组中的大部分序列与至少一个初级转录物联系起来;②在蛋白编码基因及间隔区中识别出多个新型非编码RNA分子;③许多调节簇是未被发现的TSS区,而不是增强子;④TSS区周边的调控序列经常与上游区呈无分别的对称分布;⑤TSS区的存在及活性可以通过染色质的可接近性和组蛋白的修饰模式进行预测;⑥开放染色质的远端区与TSS区具有显著不同的组蛋白修饰模式;⑦大多数进化限制的、实验鉴定的功能元件在人类群体中存在负选择性。
-
ENCODE计划的目标就是关注染色质标记和调控序列,如DHS的冗余问题。ENCODE数据的图形化表示为基因组区的特征提供了直观性的描述。
-
ENCODE计划中的一些染色质特征可以作为其他计划选用的不同细胞模型的补充信息。
-
目前人类基因组中大多数进化限制序列已与实验中识别的一些功能信息联系起来。
-
许多ChIP-seq研究的结果表明:①转录因子在基因组上结合位点的数目差别巨大;②转录因子实际结合事件显著超过已知或可能的靶基因数目;③ChIP-seq峰下仅小部分序列中含有目的转录因子的结合位点。
-
特定基因组区域外的转录因子结合位点是低亲和性的,它并不直接调节结合位点附近基因的转录。
-
单个转录因子和基因组调控区结合后可能不会有任何功能效应,需要其他因子结合到相同的调控区才能调控基因的表达。
-
大多数具有松散结合模式的转录因子在ChIP-seq分析中存在许多结合位点,而严谨结合模式的转录因子在基因组中的结合位点则较少。
-
de novo 基序搜索显示严谨结合模式的转录因子在ChIP-seq峰值下具有高的基序百分比,而松散结合因子的基序百分比相当低。
-
将转录因子结合位点与最近距离的基因联系起来是不合适的,可能导致:①靶标基因错误分配转录因子;②低估调控特定基因表达的转录因子数量。
-
为了实验确定特定转录因子的靶标基因,通常会在合适细胞模型中敲除或过表达该因子的基因。但是,这些策略存在很多问题,并会导致错误的结果。
-
对基因组DNA三维结构的理解可以解决转录因子和靶标基因的匹配问题。