来源:单细胞天地
一、单细胞测序
学习scRNA-seq先了解一下Bulk RNA-seq
- Bulk RNA-seq:
测量一个大的细胞群体中每一个基因的平均表达水平,对比较转录组学(例如比较 不同物种的相同组织) 是有帮助的,但对于研究异质性系统(例如,复杂的组织如脑)还是不够的,对于基因表达的本质研究不够深入。
- scRNA-seq:
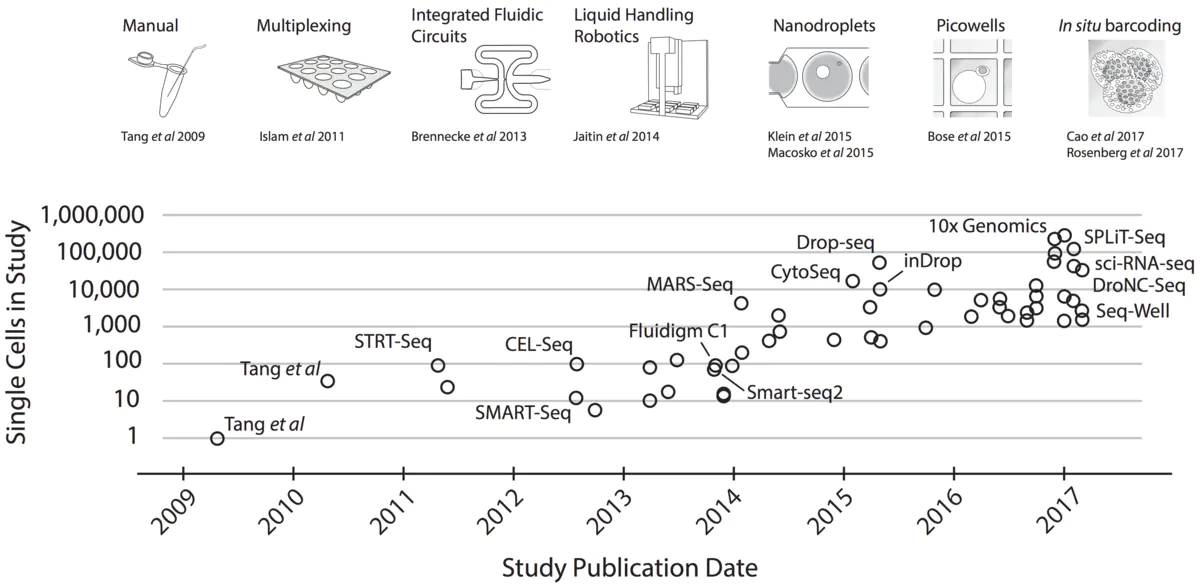
2009年由Tang首创,随着测序技术的发展及测序成本的的下降,2014年才逐渐流行开来。它测定的是细胞种群中每个基因的表达量分布,对于研究特定细胞转录组的变化是重要的。
通量:测定的细胞量也由最初的10个左右,达到了现在的百万并且还在不断递增,向着高通量的方向发展。
测序流程:现在主流的主要10X Genomics Chromium(较多细胞),SAMRT-seq2(较多基因)和Fluidigm C1等。当然还有其他的如:CELL-seq、Drop-seq、mas-seq和Wafergen ICELL8等。
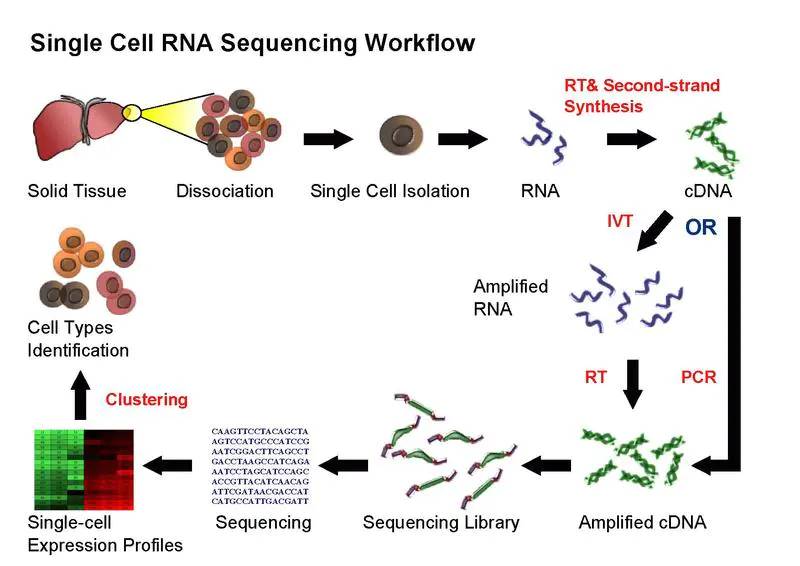
二、单细胞测序流程
三、方法主要分为两大部分:定量与分离
- 单细胞定量
包括两种类型:全长以及基于标签(tag)。前者对每个转录本都试图获得一致的read覆盖度,后者只捕获5‘或者3’端的RNA。定量方法的选择也影响了后续分析的方法选择。理论上,全长的方法应该得到转录本的平均覆盖度,但是实际上,覆盖度经常是有偏差的。基于标签的方法能够利用特异性分子标记(Unique Molecular Identifiers, UMIs)提高定量准确度,但是呢,这种限制了转录组一端的方法有降低了转录本的可拼接性,让以后的isoform识别变得困难。
- 单细胞分离(Isolation of Single Cells)
单细胞分离方法:包括有限稀释法(Limiting dilution technique)显微操作法(micromanipulation)、流式细胞分选(FACS)、激光捕获显微分离(LCM)、微孔(microwell)、微流控(microfluidics)和微滴(droplet)。
有限稀释技术(Limiting dilution technique)是利用移液管稀释分离细胞,这种方法的主要缺点是效率低下,成功率20%左右。
显微操作法(micromanipulation)是一种经典的方法,用于从少量细胞样本中提取细胞,如早期胚胎或未培养的微生物,缺点是耗时和低通量的。
流式细胞分选(FACS)广泛用于分离单个细胞,在悬浮状态下需要较大的起始体积(>10,000个细胞)。
激光捕获显微分离(LCM)是利用计算机辅助的激光系统将单个细胞从固体组织中分离出来。
微孔(microwell) 优势是可以与荧光触发细胞分离技术(FACS)结合,实现基于表面标记的细胞选择。对于想要分离特定细胞群的研究很有效;另外一个优势就是,可以对细胞进行拍照,帮助确定孔中是否存在损伤的或者重复的细胞。缺点是通量低,对每个细胞进行操作需要很大的工作量。
微流控(microfluidics)相对微孔,它的通量更高。缺点是只有10%的细胞能被捕获到,加入处理的细胞类型比较稀少,那么能被芯片捕获的就更少了,通量不高,成本高。
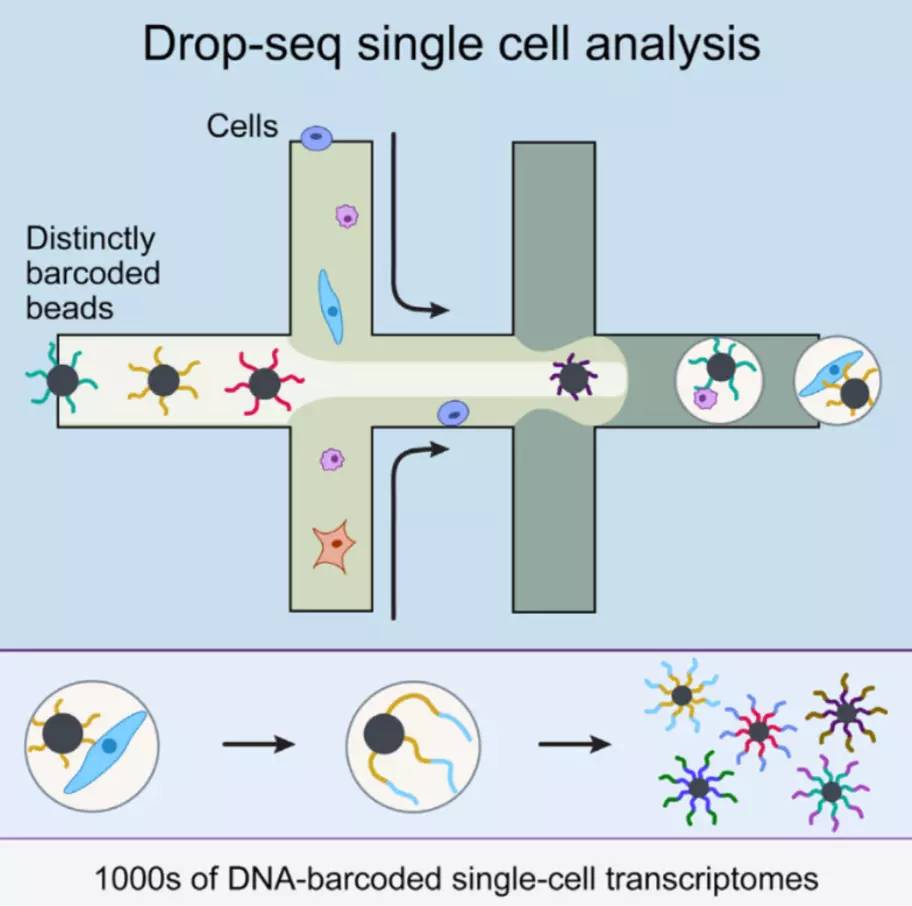
微液控制技术 例如Fluidigm’s C1(下图)。
微滴技术 是将单个细胞包裹在µl级别的液滴中,液滴被搭载到建库所用的酶上,每个微滴包含一个独特的条码(barcode),由那个被包装好的细胞产生的所有reads都被贴上了该条码,也是为了之后对于不同细胞reads的分辨。一般微滴技术的通量最大,查资料得知一秒能包装7万个以上的液滴,并且建库费用合适–0.05美元/细胞。但是高额测序费用又成了他的短板,鉴定出的一般只有一千多个差异转录本,覆盖度还是比较低的(下图)。
这些单细胞分离方案具有各自的优点,可以根据研究目的来选择合适的分离方法。
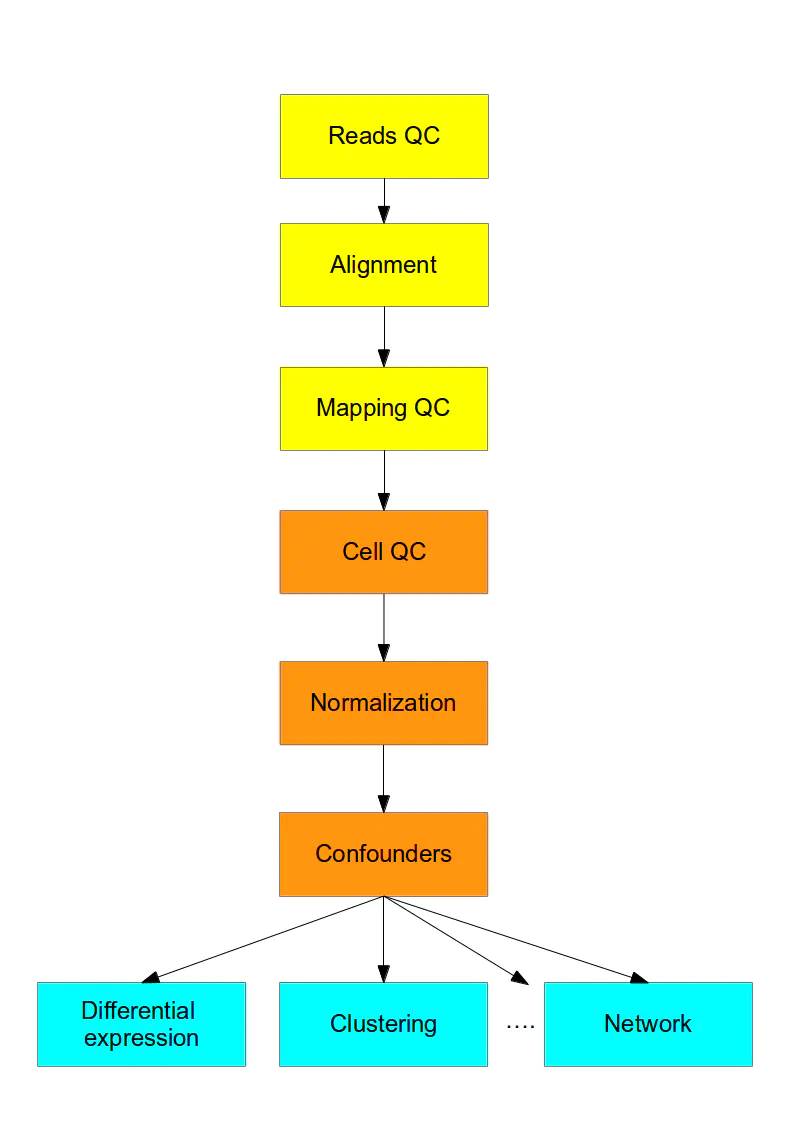
四、分析流程
- 黄色部分对于高通量数据的处理都是差不多的流程;
- 橙色的部分需要整合多个转录组分析流程以及显著性分析,来解决单细胞测序的技术误差;
- 蓝色是下游表达量、通路、互作网络等分析,需要使用针对单细胞研发的方法。
五、应用
单细胞技术揭示细胞的异质性、细胞分化、发育过程中不同的生理状态下的变化、疾病发生病变等生物学过程。
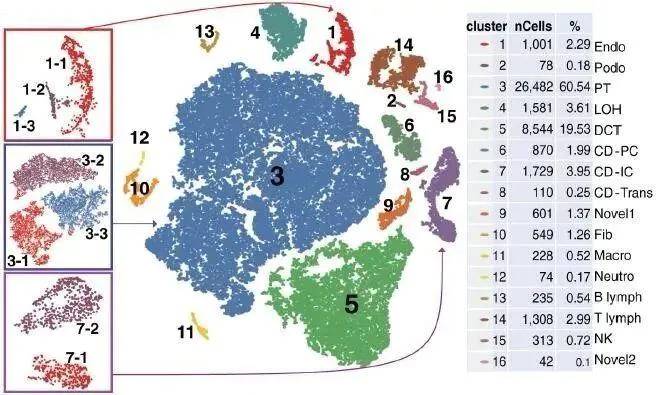
5.1 大规模细胞图谱构建
特定组织裂解后通过单细胞测序获得单细胞转录组图谱,并基于每个细胞基因表达谱数据进行细胞类型聚类,分析研究复杂器官中不同细胞亚型的功能,了解细胞间的差异以及各种细胞群体间的协作关系。
5.2 细胞亚群细化&稀有细胞类型鉴定
在单细胞类型聚类基础上,依照已知细胞类型标志基因表达情况和新基因表达情况,进一步细分细胞类型并发现新的细胞亚群,分析各个小亚群细胞差异,小亚群细胞和稀有细胞类型在生物学过程参与的功能。
5.3 肿瘤方向研究
- 肿瘤细胞异质性
- 肿瘤微环境
- 肿瘤耐药性
- 肿瘤干细胞分化
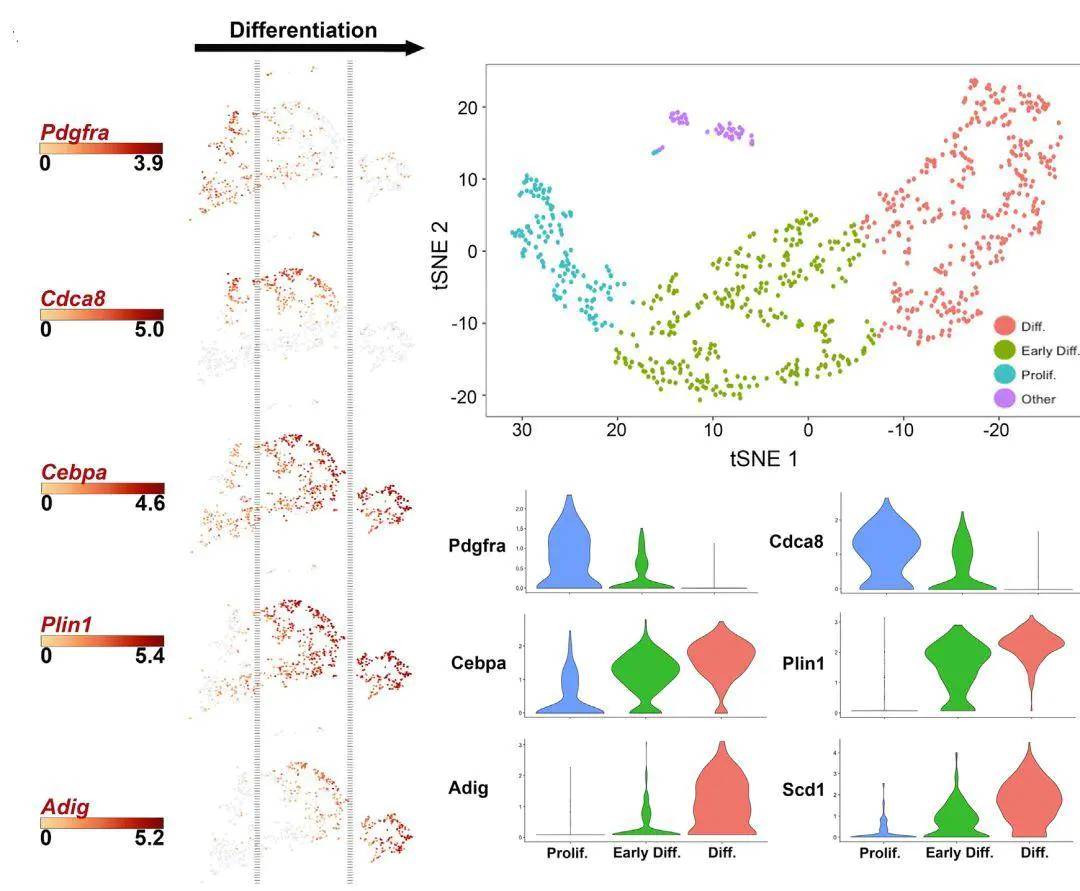
5.4 干细胞发育及分化研究
通过单细胞测序全面解析干细胞异质性,鉴定干细胞分化不同阶段的不同类型分化过程细胞,鉴定不同亚型干细胞Marker基因,绘制干细胞发育和分化轨迹,解析干细胞发育和分化的分子机理。
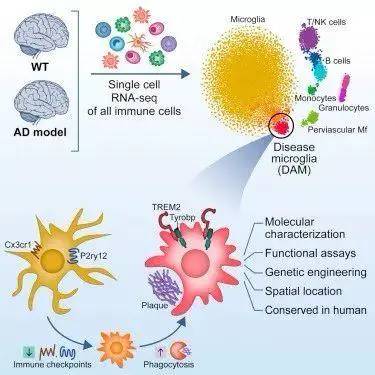
5.5 免疫方向研究
- 构建免疫图谱:
构建血液或肿瘤微环境、特定组织器官或疾病状态下免疫细胞构成,分析免疫细胞异质性,解析机体复杂的免疫机制;发现新的免疫细胞Marker基因,鉴定稀有免疫细胞类型。
- 免疫细胞分化:
鉴定不同疾病状态、诱导条件下免疫细胞基因表达变化,鉴定不同分化方向免疫细胞Marker基因,绘制免疫细胞细胞发育和分化轨迹。
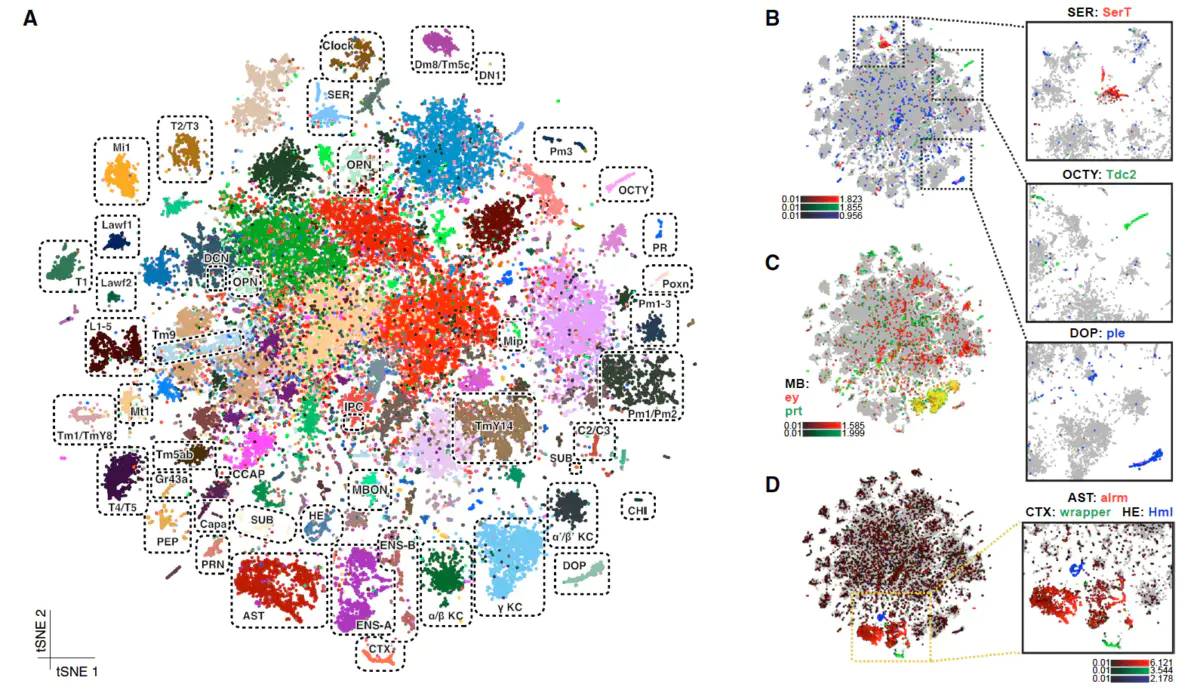
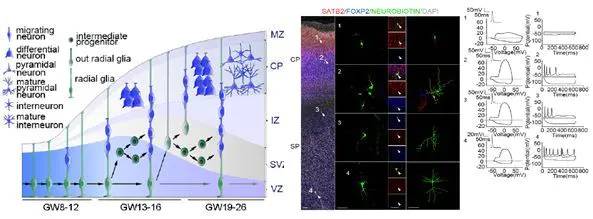
5.6 神经科学研究
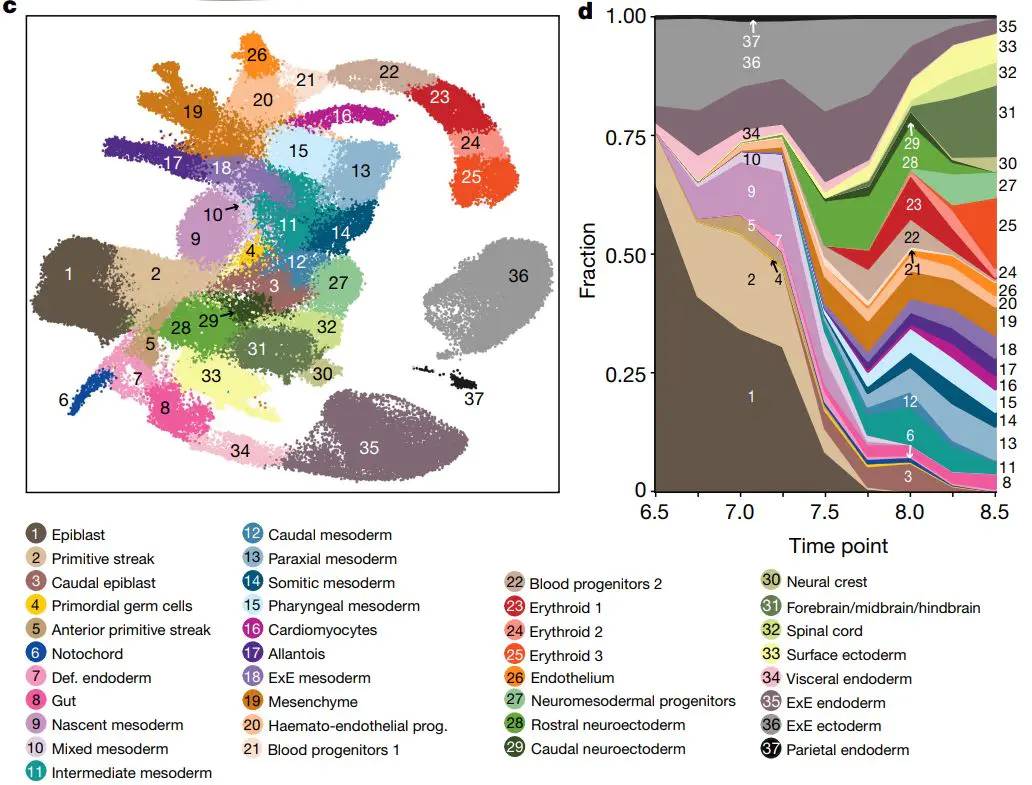
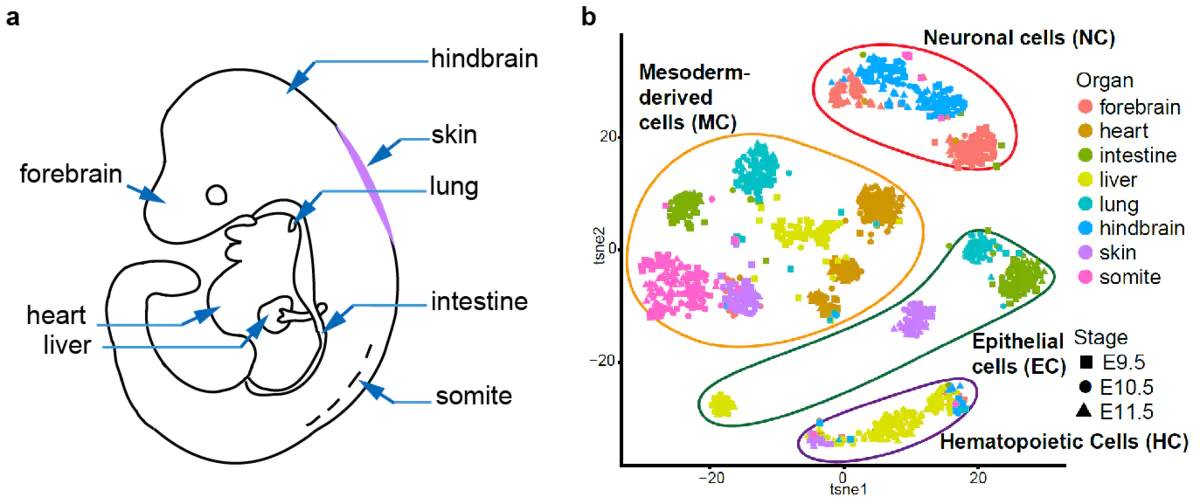
5.7 发育生物学
可以获得复杂的脑细胞基因表达图谱,构建脑细胞群体,解析脑细胞的异质性以及不同亚群细胞的特定功能。
- 胚胎细胞发育研究
5.8 生物标志物/疾病分型
发现并鉴定异常增殖的细胞类型,结合传统病理学特征,辅助疾病分型。